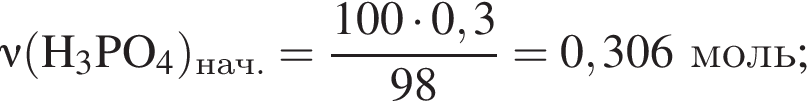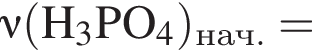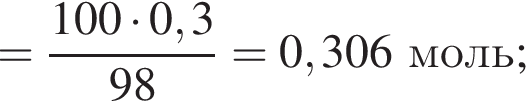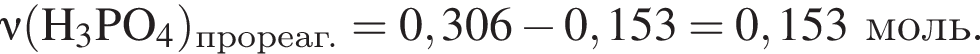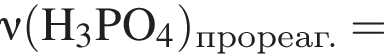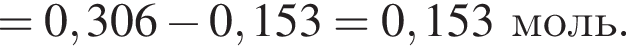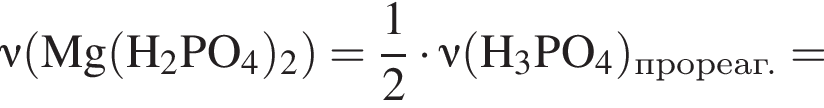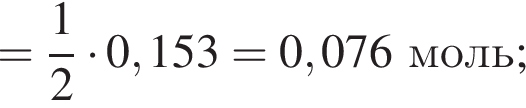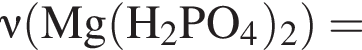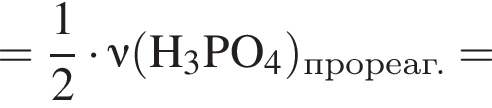Число элементов-металлов, расположенных в группе IIIА периодической системы, равно:
Число нейтронов в составе атома ![]() равно:
равно:
Атом ![]() и анион водорода
и анион водорода ![]() в основном состоянии подобны между собой:
в основном состоянии подобны между собой:
Высшему оксиду элемента, порядковый номер которого 33, соответствует гидроксид состава:

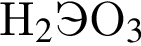

В сосуд, показанный на рисунке, методом вытеснения воздуха (Мr = 29) можно собрать газ:
Выберите формулу вещества, в котором присутствуют как ковалентная полярная, так и ионная связи:

В атоме химического элемента ![]() в основном состоянии электроны распределены по энергетическим уровням следующим образом: 2, 8, 7. Степень окисления
в основном состоянии электроны распределены по энергетическим уровням следующим образом: 2, 8, 7. Степень окисления ![]() в высшем оксиде равна:
в высшем оксиде равна:
Укажите ряд химических элементов, каждый из которых образует оксид состава ![]() и гидроксид состава
и гидроксид состава 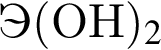 :
:
Лакмус приобретает синюю окраску в растворе, который образуется при растворении в воде оксида :
В атмосфере кислорода НЕ горит вещество:
Укажите НЕВЕРНОЕ утверждение:
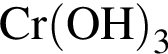 — это щелочь
— это щелочьСогласно положению в периодической системе в порядке усиления неметаллических свойств элементы расположены в ряду:
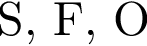
Укажите НЕПРАВИЛЬНОЕ утверждение относительно водорода:
Укажите НЕПРАВИЛЬНОЕ утверждение:
В состав полипептида, состоящего из остатков глицина, НЕ входит элемент:
Первичным амином является:

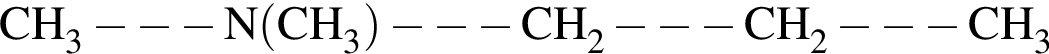
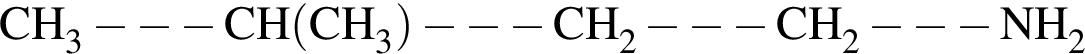
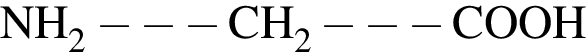
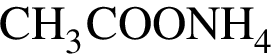
Дан перечень органических веществ:
Классифицируйте перечисленные вещества по гомологическим рядам.
В ответ запишите число гомологических рядов, например: 5.
Установите соответствие между органическим веществом и его изомером.
А) бутановая кислота
Б) бутанол-1
В) пентен-2
Г) гексин-1
1) гексадиен-1,3
2) 2-метилпропанол-2
3) этилацетат
4) бутен-1
5) пентен-1
Ответ запишите в виде сочетания букв и цифр, соблюдая алфавитную последовательность букв левого столбца, например: А2Б1B3Г4.
Алкин массой 104,00 г полностью сожгли в избытке кислорода. Образовавшийся углекислый газ смешали с гелием объемом (н. у.) 56,00 дм3. Молярная масса полученной при этом смеси газов составила 34,20 г/моль. Определите молярную массу (г/моль) алкина.
Для осуществления превращений по схеме
![]() →
→ 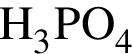 →
→ 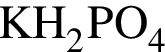 →
→ 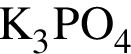 →
→ ![]()
выберите реагенты из предложенных:
1 — ![]()
2 — ![]()
3 — 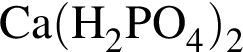
4 — 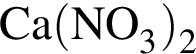
5 — 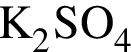
Ответ запишите цифрами в порядке следования превращений, например: 2443. Помните, что один реагент может использоваться несколько раз, а другой — не использоваться вообще.
В четырех пронумерованных пробирках находятся органические вещества.
О них известно следующее:
— в пробирке № 1 — кристаллическое вещество, плохо растворимое в холодной воде;
— в пробирке № 2 находится жидкость (20 °C), которая смешивается с водой в любых соотношениях и вступает в реакцию с  с выделением газа;
с выделением газа;
— вещества в пробирках № 1, № 3 и № 4 вступают в реакцию с бромной водой, при этом в пробирках № 1 и № 4 образуются осадки белого цвета.
Установите соответствие между названием органического вещества и номером пробирки, в которой находится указанное вещество.
А) анилин
Б) фенол
В) гексен-1
Г) уксусная кислота
1
2
3
4
Ответ запишите в виде сочетания букв и цифр, соблюдая алфавитную последовательность букв левого столбца, например: А1Б4B2ГЗ.
Для растворения смеси оксидов ![]() и
и ![]() массой 22 г необходимо 175 г раствора серной кислоты с массовой долей растворенного вещества 21%. Найдите массовую долю (%) кислорода в данной смеси оксидов.
массой 22 г необходимо 175 г раствора серной кислоты с массовой долей растворенного вещества 21%. Найдите массовую долю (%) кислорода в данной смеси оксидов.
Вычислите сумму молярной массы (г/моль) галогенсодержащего вещества X и числа атомов в формульной единице галогенсодержащего вещества Y.
К раствору серной кислоты массой 300 г с массовой долей 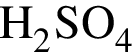 16% прибавили раствор иодида бария массой 100 г. При этом массовая доля серной кислоты растворе уменьшилась до 9%. Рассчитайте массовую долю (%)
16% прибавили раствор иодида бария массой 100 г. При этом массовая доля серной кислоты растворе уменьшилась до 9%. Рассчитайте массовую долю (%) ![]() в добавленном растворе.
в добавленном растворе.
Найдите сумму молярных масс (г/моль) цинксодержащих веществ В и Д, образовавшихся в результате превращений, протекающих по схеме
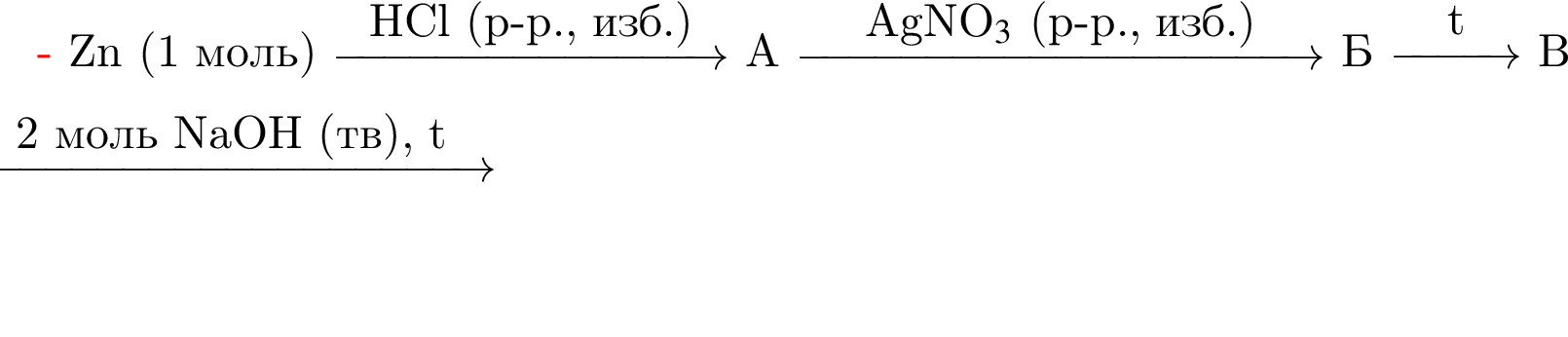
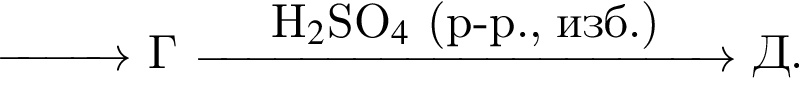
Найдите сумму молярных масс (г/моль) органических веществ В и Д, образовавшихся в результате превращений, протекающих по схеме
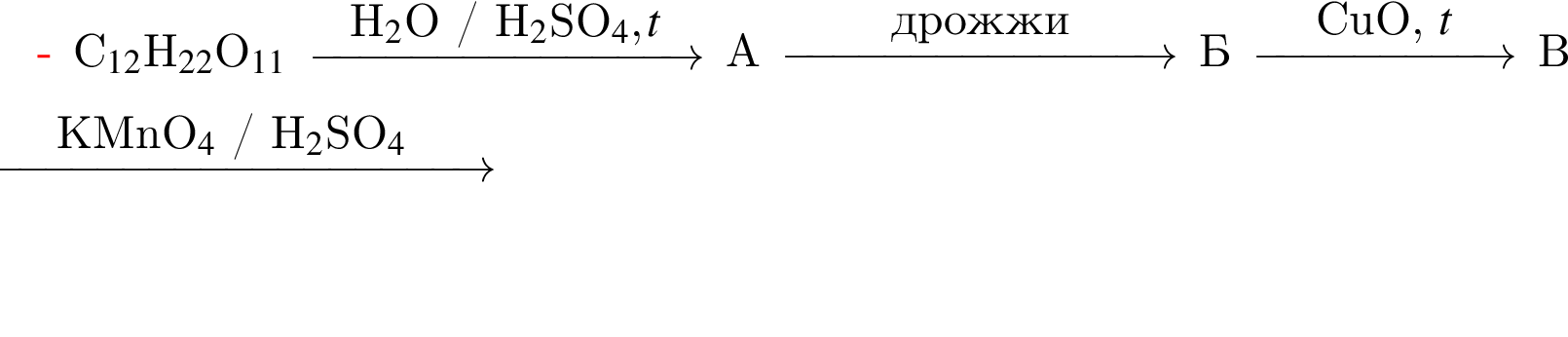
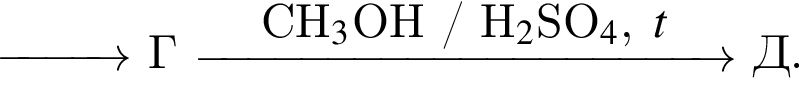
При полном сгорании метана химическим количеством 1 моль в кислороде выделяется 890 кДж теплоты, а в озоне — 1032 кДж. В результате сгорания смеси объемом (н. у.) 35,392 дм3, состоящей из метана и озонированного кислорода (смесь озона с кислородом), газы прореагировали полностью с образованием углекислого газа и воды. Определите количество теплоты (кДж), выделившейся при этом, если доля озона в озонированном кислороде составляет 32% по объему.
Определите сумму молярных масс (г/моль) серосодержащих веществ Б, Е и алюминий содержащего вещества Д, полученных в результате превращений (Б является кислой солью)
Для корректировки дефицита железа в корм цыпленка бройлера добавляют кристаллогидрат соли железа в расчете 81 мг металла на 1 кг корма. Массовые доли химических элементов в кристаллогидрате составляют: 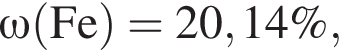
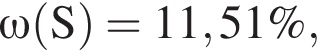
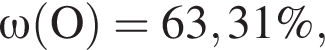
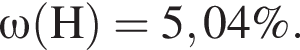 Вычислите массу (мг) кристаллогидрата в 500 г корма.
Вычислите массу (мг) кристаллогидрата в 500 г корма.
Установите соответствие между формулами реагентов и суммой коэффициентов в сокращенном ионном уравнении реакции между ними в разбавленном водном растворе.
А) ![]() и
и 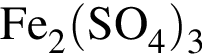
Б) ![]() и
и ![]()
В) 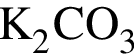 и
и 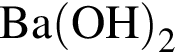
Г) ![]() и
и ![]()
1) 6
2) 7
3) 3
4) 4
5) 5
Ответ запишите в виде сочетания букв и цифр, соблюдая алфавитную последовательность букв левого столбца, например: А1Б4ВЗГ1. Помните, что некоторые данные правого столбца могут использоваться несколько раз или вообще не использоваться.
К твердой смеси, состоящей из 78 г сульфата магния, 35 г мрамора и 82,8 г карбоната калия, добавили избыток дистиллированной воды и перемешали. Полученную суспензию отфильтровали, а образовавшийся на фильтре осадок высушили и взвесили. К отфильтрованному раствору добавили избыток раствора нитрата бария, в результате чего выпал новый осадок. Рассчитайте сумму масс (г) обоих осадков.
Порцию кристаллогидрата соли 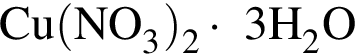 прокалили. Образовался черный порошок, а остальные продукты реакции были полностью поглощены водой. Образовавшийся раствор сильной кислоты объемом 3 дм3 имеет
прокалили. Образовался черный порошок, а остальные продукты реакции были полностью поглощены водой. Образовавшийся раствор сильной кислоты объемом 3 дм3 имеет ![]() Рассчитайте массу (г) черного порошка.
Рассчитайте массу (г) черного порошка.
Клубеньковые бактерии, живущие в земле в симбиозе с бобовыми растениями, накапливают в год 400 кг элемента азота на 1 га почвы. Вычислите массу (кг) сульфата аммония, способного заменить азот, для накопления которого на 0,14 га почвы понадобилось бы 1,5 года.
Дано термохимическое уравнение сгорания этена:
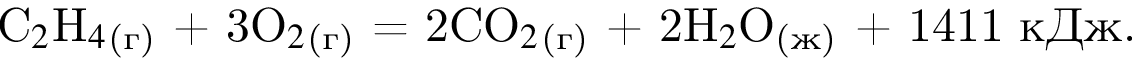
Рассчитайте, какое количество теплоты (кДж) выделится, если в реакцию вступит 86,8 г смеси этена и кислорода, взятых в объемном соотношении 1:3 соответственно.
В избытке воды растворили 22,5 г медного купороса, а затем — 12 г сульфида бария. Образовавшуюся смесь профильтровали, осадок отделили и высушили. Вычислите массу (г) полученного в результате эксперимента твердого остатка.
Рассчитайте, какую массу (г) железного купороса 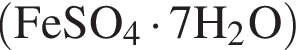 необходимо добавить в раствор массой 175 г с массовой долей сульфата железа(II) 8%, чтобы приготовить раствор с массовой долей соли 15%.
необходимо добавить в раствор массой 175 г с массовой долей сульфата железа(II) 8%, чтобы приготовить раствор с массовой долей соли 15%.
Порцию порошка карбоната магния нагрели до высокой температуры. При этом масса порошка снизилась на 45%. Определите, с каким выходом (%) протекала реакция разложения.
К раствору фосфорной кислоты массой 100 г с массовой долей кислоты 30% добавили кусочек магния. В результате реакции образовался прозрачный раствор, содержащий кислоту массой 15 г и соль с массовой долей фосфора 28,44%. Найдите массу (г) соли в полученном растворе.

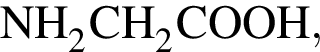 в своем составе не имеет серы.
в своем составе не имеет серы.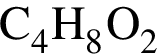 . Такую же формулу имеет этилацетат.
. Такую же формулу имеет этилацетат. 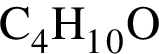 . Такую же формулу имеет 2-метилпропанол-2.
. Такую же формулу имеет 2-метилпропанол-2.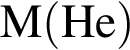 + n(
+ n(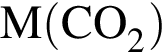 )/(n(
)/(n(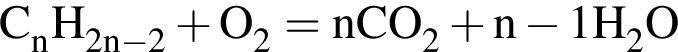
 ) = 7,7/n моль, отсюда:
) = 7,7/n моль, отсюда: = 7,7/n;
= 7,7/n;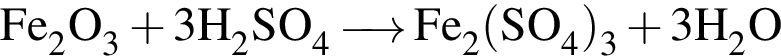

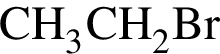 . Молекулярная масса 109 г/моль
. Молекулярная масса 109 г/моль 9 атомов в молекуле.
9 атомов в молекуле.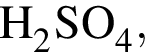
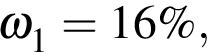
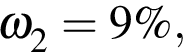 100 г.
100 г. 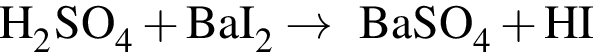
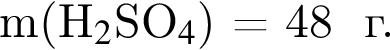
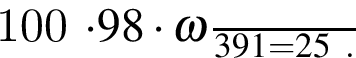
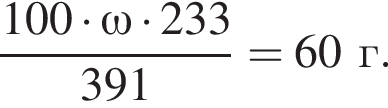
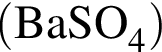
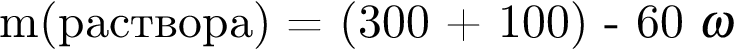
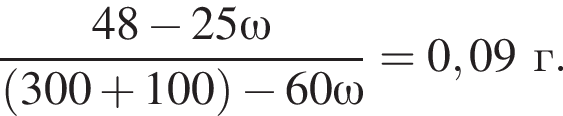

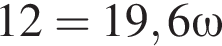
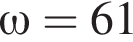
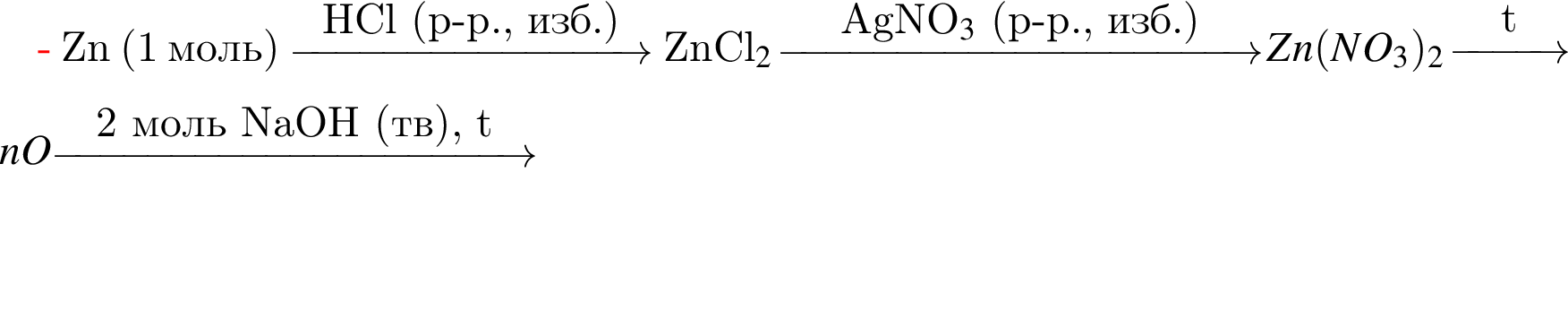
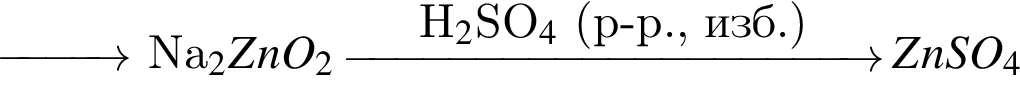
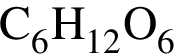 .
.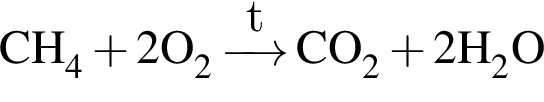
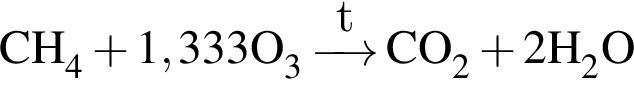
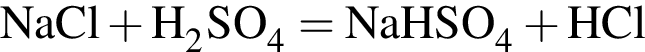 (А)
(А)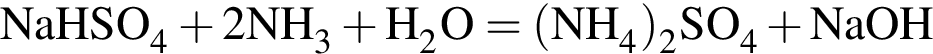 (Г)
(Г)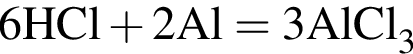 (В)
(В)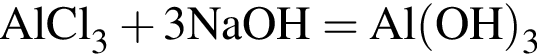 (Д)
(Д)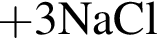
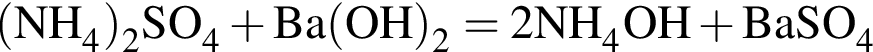 (Е)
(Е)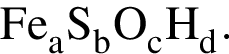 Найдем соотношение атомов железа, серы, кислорода и водорода в соединении:
Найдем соотношение атомов железа, серы, кислорода и водорода в соединении: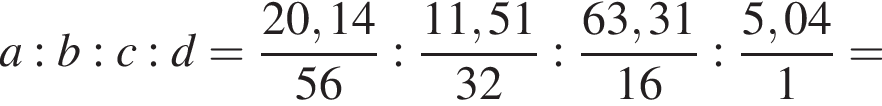
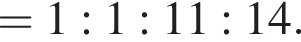
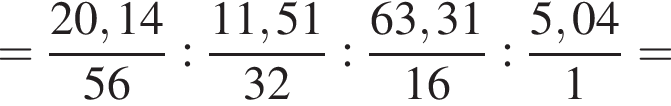
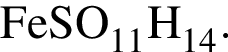 Это соответствует формуле гептагидрата сульфата железа(II) —
Это соответствует формуле гептагидрата сульфата железа(II) — 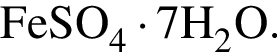
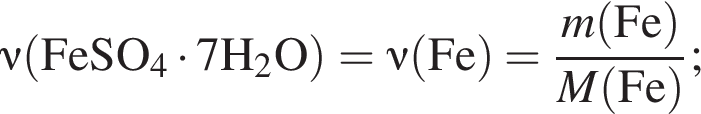
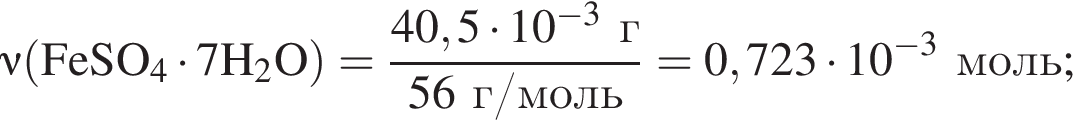
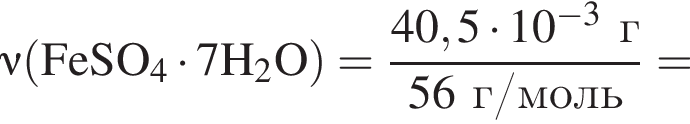
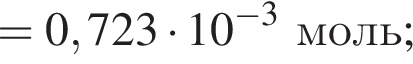
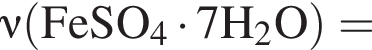
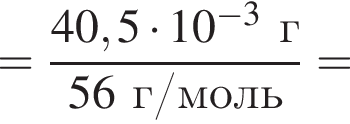
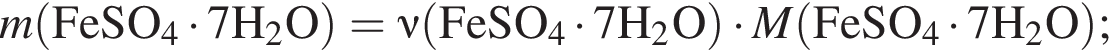
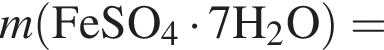
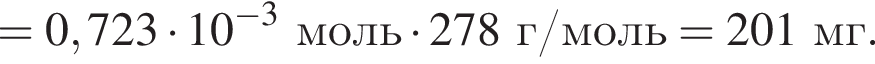

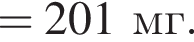
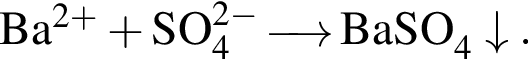 Сумма коэффициентов — 3;
Сумма коэффициентов — 3;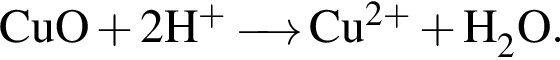 Сумма коэффициентов — 5;
Сумма коэффициентов — 5;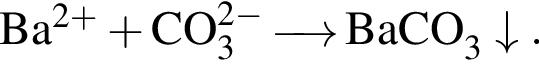 Сумма коэффициентов — 3;
Сумма коэффициентов — 3;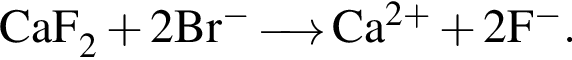 Сумма коэффициентов — 6.
Сумма коэффициентов — 6.

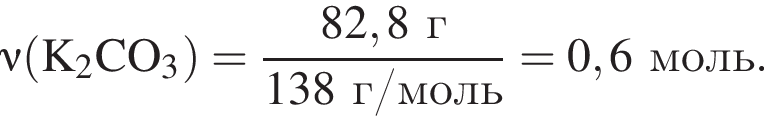
 Найдем его массу:
Найдем его массу: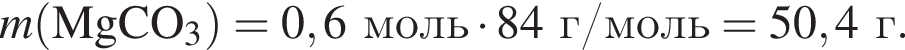

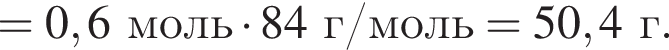
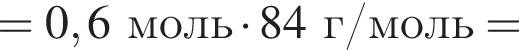
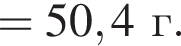
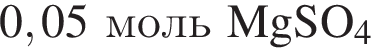 и
и 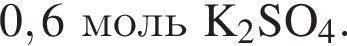 При добавлении избытка нитрата бария происходят следующие реакции:
При добавлении избытка нитрата бария происходят следующие реакции:


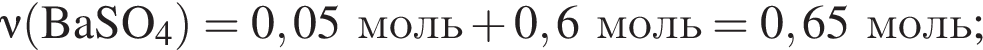

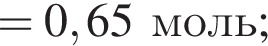


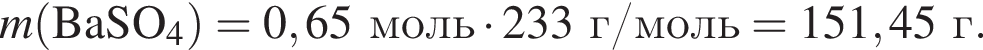

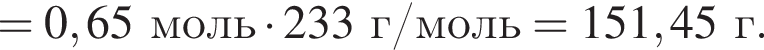
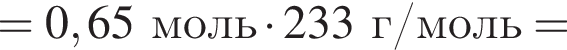
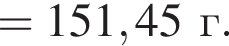



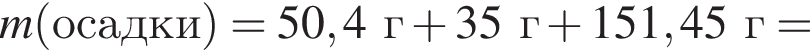
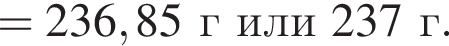
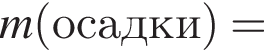
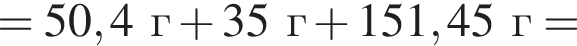
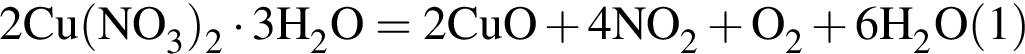
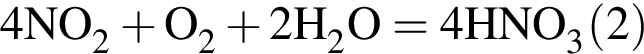
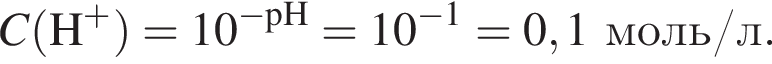
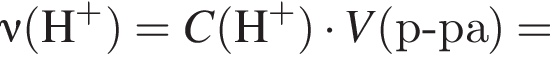
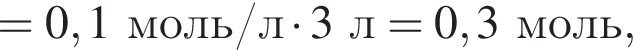
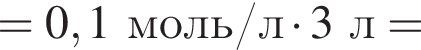
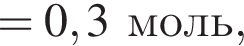

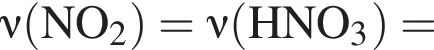
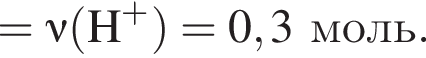
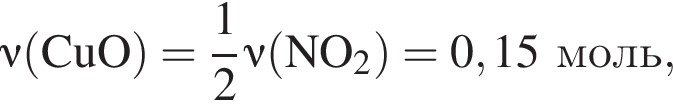




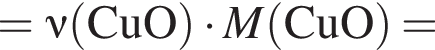
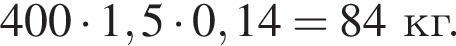 Теперь найдем, какое массовую долю занимает элемент азот в сульфате аммония:
Теперь найдем, какое массовую долю занимает элемент азот в сульфате аммония: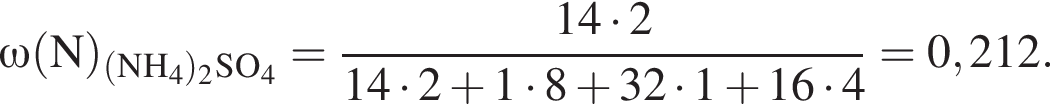

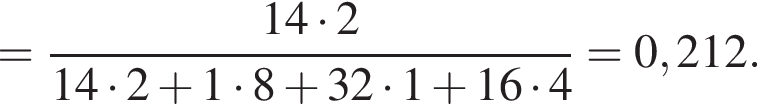
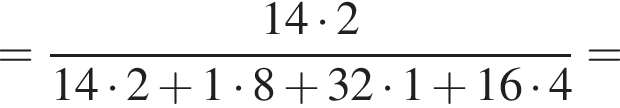
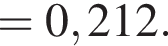
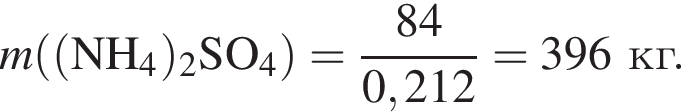
 Количество вещества кислорода равно
Количество вещества кислорода равно  Тогда:
Тогда: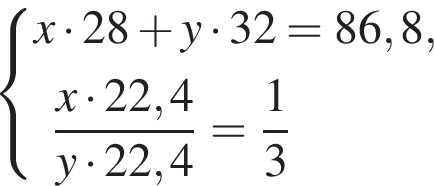
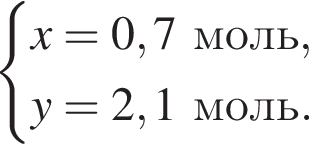
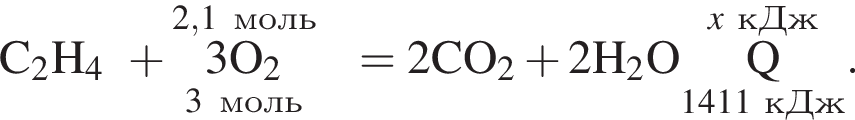
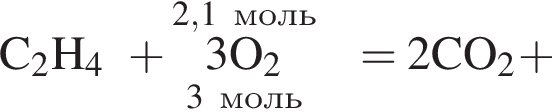
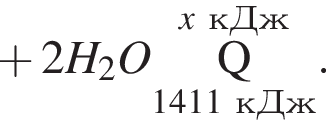
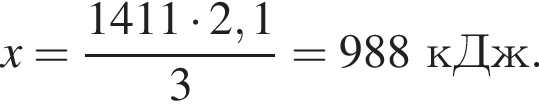


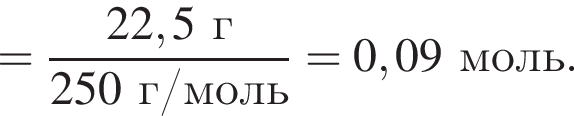

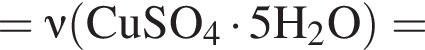

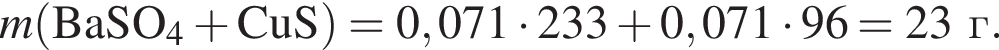
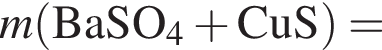
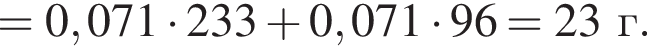
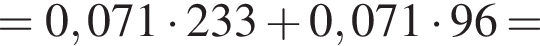




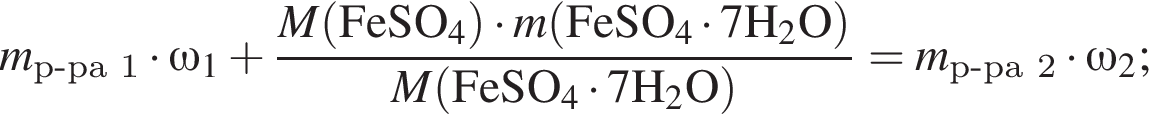
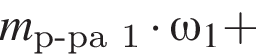
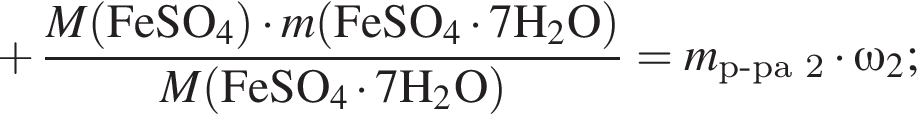
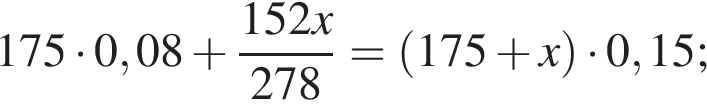
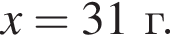
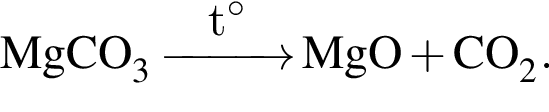
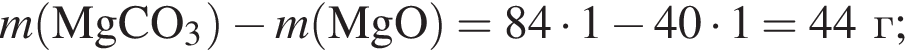

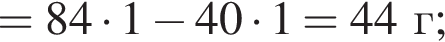
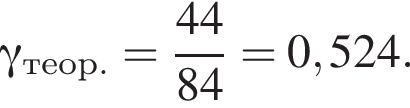
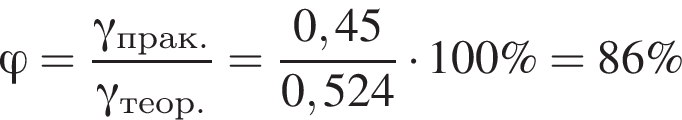
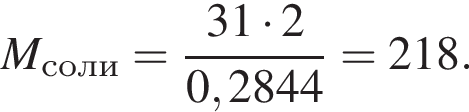
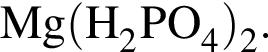 Запишем уравнение реакции:
Запишем уравнение реакции: